2020-01-15
1月8日,《神经科学杂志》在线发表了题为Nerve Injury-Induced Neuronal PAP-I Maintains Neuropathic Pain by Activating Spinal Microglia 的研究论文。该研究由中国科学院脑科学与智能技术卓越创新中心/神经科学研究所、神经科学国家重点实验室张旭研究组和中国科学院分子细胞科学卓越创新中心/生物化学与细胞生物学研究所、细胞生物学国家重点实验室鲍岚研究组合作完成。 神经病理性痛是由神经损伤引起的一种慢性疼痛。尽管到目前为止,已经有不少研究试图揭示神经病理性痛的发生发展机制,但是对于其长时程的维持机制仍然知之甚少。胰腺炎相关蛋白(Pancreatitis-associated protein,PAP)属于钙离子依赖性凝集素家族,是一种小分子量的分泌蛋白。在神经系统中,已有研究发现PAP蛋白参与神经损伤后再生的过程。但是,PAP蛋白是否在疼痛发生发展过程中发挥作用并不清楚。 研究团队发现,PAP-I在神经病理性痛模型大鼠背根神经节(Dorsal root ganglia,DRG)神经元中表达显著升高,提示PAP-I可能在慢性痛发生发展过程中发挥作用。在神经损伤后,PAP-I的表达分布经历从小直径神经元到大直径神经元再向小直径神经元转变的过程,DRG神经元生成的PAP-I可以同时向外周和脊髓背角运输。行为学实验显示,鞘内而不是足底给予外源PAP-I蛋白可诱导痛敏,说明外周神经损伤诱导表达的并向脊髓背角运输的PAP-I具有促痛作用。与此同时,研究还发现PAP-I敲除大鼠在神经损伤后可以建立痛敏反应,但是随着时间的推移,第43天后机械触诱发痛有显著的减轻,提示PAP-I在神经病理性痛维持过程中的作用。进一步研究PAP-I的作用机制时发现,PAP-I可以作用于CC-趋化因子受体2(CC-chemokine receptor 2,CCR2),并通过CCR2-p38 MAPK途径激活脊髓小胶质细胞。给予大鼠小胶质细胞抑制剂或者CCR2抑制剂能够有效缓解PAP-I引起的痛敏反应。因此,外周神经损伤后,DRG神经元通过释放促痛因子PAP-I来维持长时程的神经病理性痛过程。 该研究由研究员张旭和鲍岚指导,张旭组博士研究生李佳音、鲍岚组博士研究生史海翔为该论文共同第一作者,同时张旭组的刘辉和董飞、陆莹瑾也做出了贡献,并得到分子细胞卓越中心研究员陈洛南和博士刘志平的大力协助。本工作得到国家自然科学基金委、中科院前沿科学重点研究项目、中科院战略先导(B类)科技专项、上海市科技重大专项等的资助。关闭窗口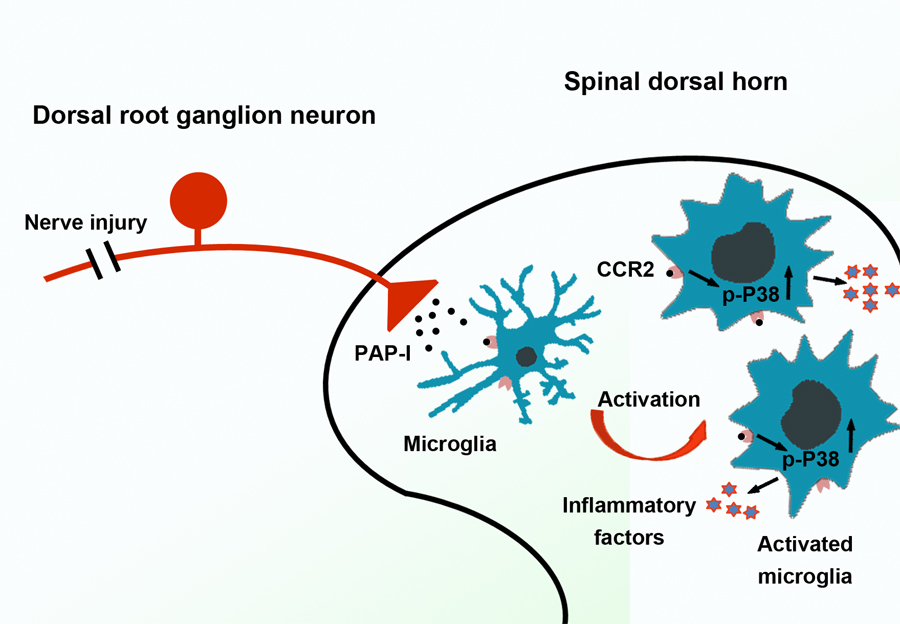
图注:外周神经损伤诱导DRG神经元生成PAP-I,向脊髓背角运输的PAP-I能够通过CCR2-p38 MAPK途径激活小胶质细胞,参与神经病理性痛的维持过程。 来源: 脑科学与智能技术卓越创新中心