2019-09-15
近日,北京理工大学生命学院霍毅欣课题组在原核生物CRISPR基因组编辑技术的优化及应用方面再次取得重要研究成果,并发表于TOP(顶级)期刊《Applied Microbiology and Biotechnology》。论文的第一作者为2019级博士生黄潮勇,通讯作者为霍毅欣教授,天工所张学礼和毕昌浩研究员、北理工马晓焉特别副研究员参与了这项研究。该研究的部分工作在北理工—洛加大苏州研究院联合实验室完成,项目获得国家自然基金委面上项目、科技部重点研发项目、北京理工大学科技创新项目、以及苏州工业园区的资助。该课题组不久前刚在Q1期刊《Microbial Cell Factories》上发表相关领域研究成果,论文的第一作者为2019届硕士毕业生张姣,通讯作者为霍毅欣教授;植生所蒋宇研究员参与了这项研究。 CRISPR/Cas9作为新一代基因组编辑技术,已经被广泛应用于动物、植物以及微生物的基因组编辑。该技术利用化脓性链球菌来源的Cas9蛋白(SpCas9)产生位点特异性DNA双链断裂,再通过细胞的同源重组(HR)或非同源末端连接(NHEJ)机制修复双链断裂,同时在基因组上引入所需要的突变。与真核生物不同,原核生物普遍难以修复DNA双链断裂,绝大多数细菌缺乏NHEJ系统,而只具有效率很低的HR系统。因此,大多数研究者选择将CRISPR/Cas9与重组工程相结合,通过过表达噬菌体来源的λ-Red系统(一种效率很高的HR系统)帮助原核生物修复DNA双链断裂,从而提高编辑效率。与NHEJ介导的基因组编辑相比,HR介导的基因组编辑需要一个供体DNA作为编辑模板,这使基因组编辑操作变得复杂。研究表明,某些原核生物具有类似真核生物的简化版NHEJ系统,这些NHEJ系统只需要两个功能蛋白Ku和LigD。大肠杆菌一直以来被认为缺乏NHEJ系统,近年来,国内有研究者将结核分枝杆菌和耻垢分枝杆菌来源的NHEJ系统导入大肠杆菌,成功地开发出了一种不依赖HR的基因组编辑方法用于快速删除大肠杆菌基因组序列,大大加速了大肠杆菌遗传改造的进程。事实上,国外有研究者证明大肠杆菌具有一个类似于NHEJ的末端连接系统(研究者将其命名为A-EJ),该系统的功能蛋白不是Ku和LigD,而是RecBCD和LigA。由于A-EJ修复DNA双链断裂的效率远低于NHEJ,目前还没有利用A-EJ进行基因组编辑的报道。是否有可能用A-EJ代替NHEJ进行基因组编辑呢?答案是肯定的。关闭窗口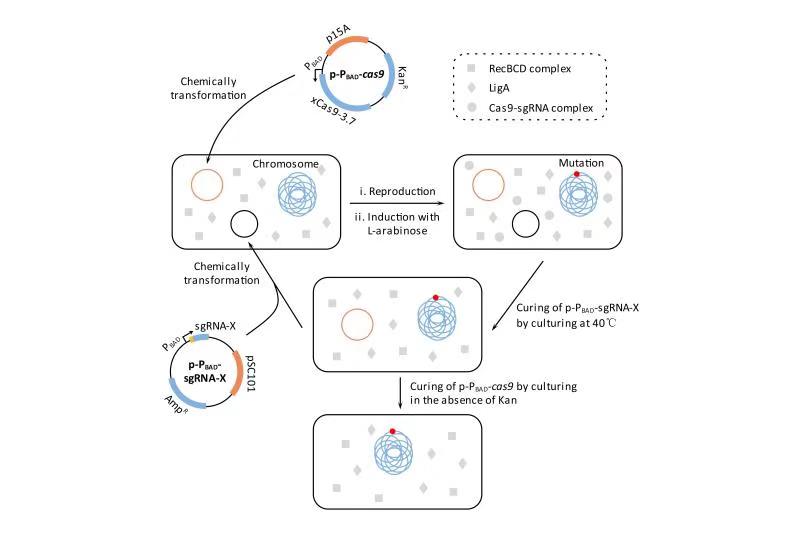
图1 基于CNEE的基因组编辑流程 北京理工大学生命学院的霍毅欣教授课题组利用David Liu课题组开发的 xCas9-3.7(SpCas9的进化版突变体)和Jennifer Doudna课题组改造的sgRNA(tracrRNA : crRNA的强化版融合体)构建了一个双质粒严谨诱导型的基因组编辑系统,并将其命名为CNEE。该系统极为简单,其功能组件只有Cas9和sgRNA,没有任何外源的DNA修复蛋白,利用该系统,即使宿主的DNA修复系统效率极低,也能高效率地进行基因组编辑。该课题组将CNEE系统导入大肠杆菌,在宿主A-EJ系统的协助下,实现了高效的基因敲除和长达83 kb的大片段删除(图1)。这种方法不需要编辑模板,可以实现快速迭代的大肠杆菌遗传改造,并且编辑效率不依赖于高转化活性的宿主细胞。由于RecBCD和LigA(或它们的同源基因)在所有的原核生物中都存在,因此理论上CNEE系统适用于任何原核生物的基因组编辑。随后,该课题组在CNEE的基础上构建了一个变异系统,为了方便描述,暂且把该系统称为CNEE-V1。将CNEE-V1导入大肠杆菌,可以在宿主RecA同源重组系统的协助下实现高效精确的基因组编辑,包括序列的删除、插入和替换。CNEE-V1是对CNEE的有效补充;由于RecA(或它的同源基因)在所有的原核生物中都存在,因此理论上CNEE-V1也适用于任何原核生物的基因组编辑。此外,该课题组还证明,将分枝杆菌来源的NHEJ系统引入CNEE可以进一步增强CNEE的性能;同样,将噬菌体来源的λ-Red系统可以进一步增强CNEE-V1的性能。相关成果发表于TOP(顶级)期刊《Applied Microbiology and Biotechnology》,原文链接:https://doi.org/10.1007/s00253-019-10104-w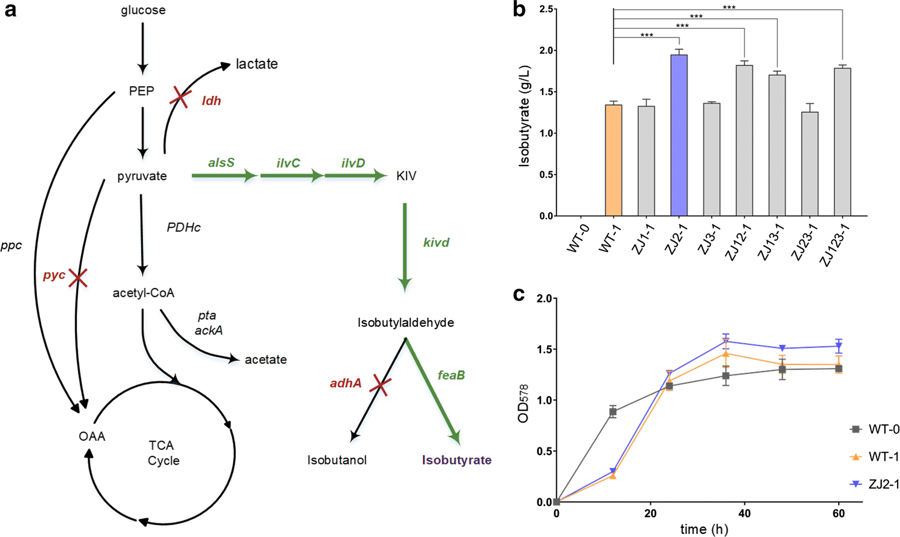
图2 谷氨酸棒杆菌遗传改造提高异丁酸产量 CRISPR/Cpf1是继CRISPR/Cas9之后被开发出来的基因组编辑系统。与CRISPR/Cas9相比,CRISPR/Cpf1脱靶率更低且所需的核酸酶和RNA分子更小,因此在基因组编辑领域具有巨大的应用潜力。然而,编辑效率相对较低限制了CRISPR/Cpf1基因编辑系统的应用。谷氨酸棒杆菌是一种重要的工业生产菌株,此前,研究者利用CRISPR/Cpf1在谷氨酸棒杆菌中进行基因组编辑的效率低于15%,且无法利用线性DNA作为修复模板。因此,该课题组针对谷氨酸棒杆菌的基因组编辑对CRISPR/Cpf1系统进行了系统的优化,优化参数包括PAM序列、间隔序列的长度、修复模板的类型。利用优化后的CRISPR/Cpf1系统在谷氨酸棒杆菌中进行基因组编辑的效率显著提高,且可以利用线性DNA作为修复模板。随后,该课题组利用优化后的CRISPR/Cpf1系统对野生型谷氨酸棒杆菌进行遗传改造,通过敲除基因 pyc 、 ldh 和 adhA 成功地提高了异丁酸的产量(图2)。相关成果发表于《Microbial Cell Factories》,原文链接:https://doi.org/10.1186/s12934-019-1109-x 附霍毅欣简介: 霍毅欣教授本科毕业于南开大学,获北京大学和巴黎七大双博士学位,曾经在法国巴斯德研究所、美国加州大学洛杉矶分校等欧美科研院校和生物公司学习和工作十三年,兼有在学术界从事基础研究和工业界开展应用转化研究的经历。2016年起在北京理工大学组建代谢工程课题组,围绕着“天然资源的微生物精炼与制造”,以“人工细胞工厂的设计-构建-筛选-放大”为主线,以多种模式生物为研究对象,开展了一系列研究,取得了多项研究成果。自2018年以来以通讯作者或第一作者身份在顶级期刊Nature Communications(1篇)、Metabolic Engineering(1篇)、Applied Microbiology and Biotechnology(4篇)、Current Opinion in Biotechnology(1篇)及重要期刊ACS Synthetic Biology(1篇)、Microbial Cell Factories(2篇)、Engineering(1篇)、Journal of Biotechnology (1篇)、JoVE(1篇)上发表论文,申请多项发明专利。来源:北京理工大学 学术网