2019-04-24
2月26日,国际学术期刊International Journal of Cancer 在线发表了中国科学院上海营养与健康研究所冯英研究组和复旦大学附属中山医院吴国豪研究组的最新合作研究成果“Cachexia-related long noncoding RNA, CAAlnc1, suppresses adipogenesis by blocking the binding of HuR to adipogenic transcription factor mRNAs”。该研究发现lncRNA CAAlnc1在癌性恶病质脂肪丢失中具有重要作用,并阐明了相应的分子机制。
癌性恶病质是肿瘤引起的一种多因素临床综合征,表现为进行性体重减轻,以脂肪组织及肌肉组织丢失为特征。50-80%的恶性肿瘤患者会发生癌性恶病质,且20%的肿瘤相关死亡与癌性恶病质相关。脂肪作为机体主要的储能组织,在癌性恶病质早期即可出现明显丢失,且能影响患者的生存。lncRNAs参与了脂肪代谢的多个过程,包括脂肪分解、脂肪酸的β氧化及脂肪分化等。然而,lncRNAs在癌性恶病质脂肪丢失中的作用尚无研究报道。
在吴国豪、冯英的共同指导下,中山医院博士研究生沈雷等利用芯片筛选了癌性恶病质脂肪丢失相关lncRNAs,并进一步探讨了癌性恶病质脂肪丢失相关lncRNAs在脂肪代谢中的功能及机制。该研究通过构建癌性恶病质小鼠模型,利用芯片对癌性恶病质小鼠脂肪中差异表达的lncRNAs进行了筛选,鉴定了多条lncRNAs在癌性恶病质小鼠脂肪中差异表达,其中CAAlnc1在癌性恶病质小鼠脂肪中高表达。敲减及过表达实验结果显示CAAlnc1能抑制脂肪分化,其可能通过抑制脂肪分化参与了癌性恶病质脂肪丢失。RNA pulldown及RIP实验结果显示CAAlnc1能与HuR结合。进一步研究发现,CAAlnc1可能通过抑制HuR与C/EBP-α及PPAR-γ mRNAs的结合而使C/EBP-α及PPAR-γ的表达降低,从而抑制脂肪分化。
该研究为癌性恶病质脂肪丢失的治疗提供了潜在的靶点,同时也为lncRNAs调控脂肪分化提供了新的理论。该项目得到国家自然科学基金委、上海市临床营养研究中心的经费支持。沈雷、韩军、王海玉为共同第一作者,冯英和吴国豪为共同通讯作者。
论文链接
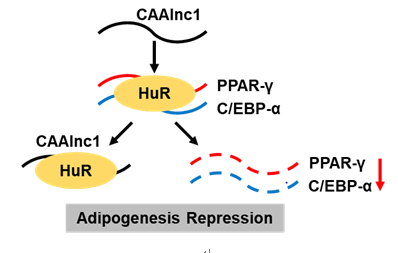
CAAlnc1抑制脂肪分化相关机制的示意图
关闭窗口