近期,国际权威期刊《美国化学会志》(J.Am.Chem.Soc.)发表化学与分子科学学院袁荃/杨雁冰团队的最新研究成果,报道了一种基于阻断癌细胞信号通路的核酸适配体抑制剂用于阻碍癌细胞的迁移。
论文题为“Regulation of Cellular Signaling with an Aptamer Inhibitor to Impede Cancer Metastasis”。化学与分子科学学院博士研究生隗予荣和硕士研究生龙诗奕为论文共同第一作者,化学与分子科学学院袁荃教授和杨雁冰研究员为共同通讯作者。
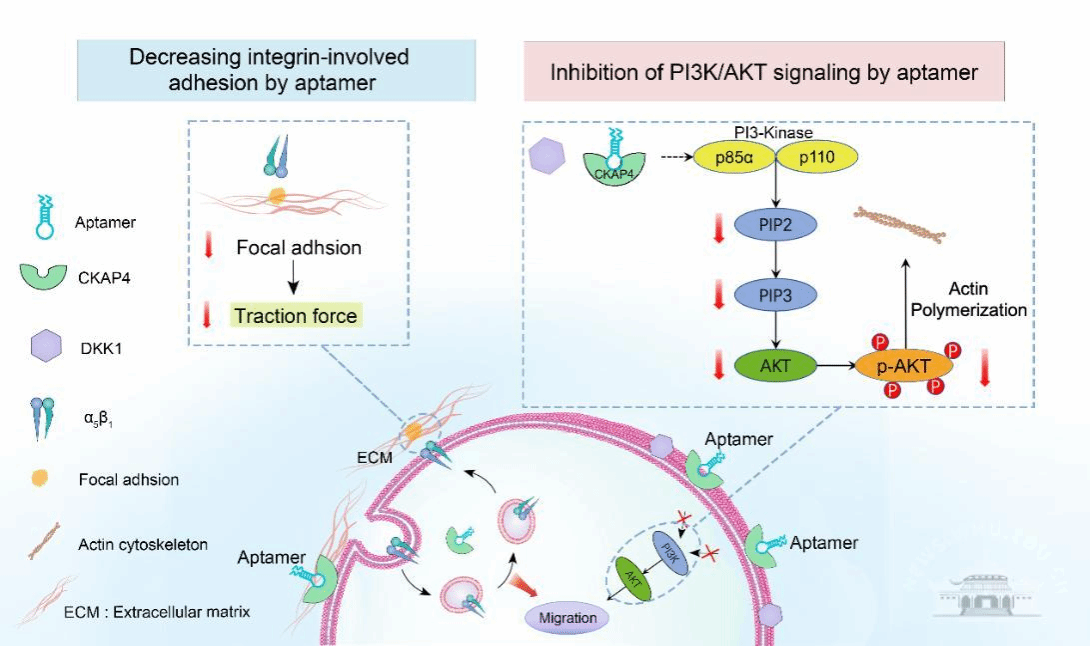
肿瘤的侵袭和转移过程是肿瘤发展的主要因素,也是癌症患者死亡的主要原因。在肿瘤的迁移过程中,有许多与肿瘤发生发展密切相关的蛋白参了该过程并起到非常重要的作用。因此,研究肿瘤发生发展过程中与癌细胞迁移密切相关的蛋白对开发新的治疗方法、指导临床治疗具有重要意义。细胞骨架相关蛋白4(CKAP4)是一种在多种癌细胞中过度表达的跨膜蛋白,CKAP4参与调节癌细胞粘附功能,并在癌细胞迁移相关的信号通路中扮演了重要角色。CKAP4参与α5β1整合素的内化和运输过程,调节纤维连接素依赖的细胞粘附能力变化。此外,CKAP4与分泌蛋白DKK1结合激活磷酸肌醇3激酶(PI3K)-AKT信号通路,调控骨架蛋白的重组并促进细胞迁移过程。考虑到CKAP4在肿瘤中迁移中的多重促进作用,CKAP4犹如肿瘤发生发展进程当中的“潘多拉魔盒”,是肿瘤的一个重要治疗靶点。以与癌症迁移密切相关的蛋白CAKP4为研究对象,开发新的治疗方法对于指导临床治疗具有重要意义。
适配体,通常被称为化学抗体,其具有高度的特异性和亲和力、低免疫原性、可重复制造和快速渗透组织的能力,在药理开发中具有巨大的潜力。该研究基于适配体疗法的作用机制,提出了适配体抑制剂阻断蛋白质功能的药理学机制,开发了以CKAP4为靶点的适配体抑制剂疗法。该研究发现了CKAP4适配体会干扰CKAP4与配体整合素β1和配体DKK1的相互作用,不仅影响α5β1整合素介导细胞粘附功能,削弱细胞转移中的牵引力,还抑制CKAP4/DKK1启动的磷脂酰肌醇 3-激酶/蛋白激酶 B (PI3K/AKT)信号通路,阻碍该信号通路调控的细胞骨架重组过程,抑制了癌细胞的迁移与侵袭行为。该研究提出的具有单一靶向实现多重信号通路抑制的核酸适配体为癌症的治疗提供了新的思路,为阻碍肿瘤的发生、发展过程提供了新的指导思想。
 论文的合作者还包括武汉大学化学与分子科学学院向立民教授、湖南大学叶茂教授和谭蔚泓院士。武汉大学科研公共服务条件平台和武汉大学化学与分子科学学院为此项工作的开展提供了有力的支撑。该项研究获得了国家科学技术部、国家自然科学基金委、中央高校基本科研业务费专项资金的经费支持。
论文原文:https://pubs.acs.org/doi/10.1021/jacs.3c09091
论文的合作者还包括武汉大学化学与分子科学学院向立民教授、湖南大学叶茂教授和谭蔚泓院士。武汉大学科研公共服务条件平台和武汉大学化学与分子科学学院为此项工作的开展提供了有力的支撑。该项研究获得了国家科学技术部、国家自然科学基金委、中央高校基本科研业务费专项资金的经费支持。
论文原文:https://pubs.acs.org/doi/10.1021/jacs.3c09091 |