天然免疫识别在抗肿瘤免疫应答中发挥重要作用,越来越多的研究发现激活核酸感受通路将助力肿瘤治疗。然而肿瘤微环境具有高度异质性,对微环境内核酸感受通路在肿瘤免疫应答的调控作用及演变规律缺乏系统性的认识。邓刘福教授团队致力于研究肿瘤中T细胞应答与核酸感知的内在联系,前期研究基础,发现了肿瘤中CD8+ T细胞干性程序存在性别差异的规律(Immunity,2022),揭示了肿瘤中CD8+ T细胞干性程序具有先天性的一面(Science Translational Medicine,2020),阐明了放疗诱导的免疫原性死亡驱动CD8+ T细胞应答的核酸识别机制(Science Advances,2021)。T-树突状细胞(dendritic cell,DC)交互是级联放大抗肿瘤免疫应答的关键环节,然而RNA识别通路对肿瘤中T-DC细胞交互的调控机制尚不清楚,亟待研究阐明。
近日,邓刘福教授团队在Science Immunology杂志上发表题为“Noncanonical MAVS signaling restrains dendritic cell-driven antitumor immunity by inhibiting IL-12”的研究论文,揭示了DC中的天然免疫识别RIG-I-MAVS通路发挥“非经典”功能,负向调控抗肿瘤免疫应答。DC缺失MAVS能通过上调白介素-12(interleukin 12, IL-12)而非I型干扰素增强DC功能,进而促进DC-T细胞相互作用,协同增强肿瘤免疫治疗效果(图1)。该研究为理解肿瘤中DC应答规律提供了新视角,为克服肿瘤免疫治疗抵抗提供了新靶点。
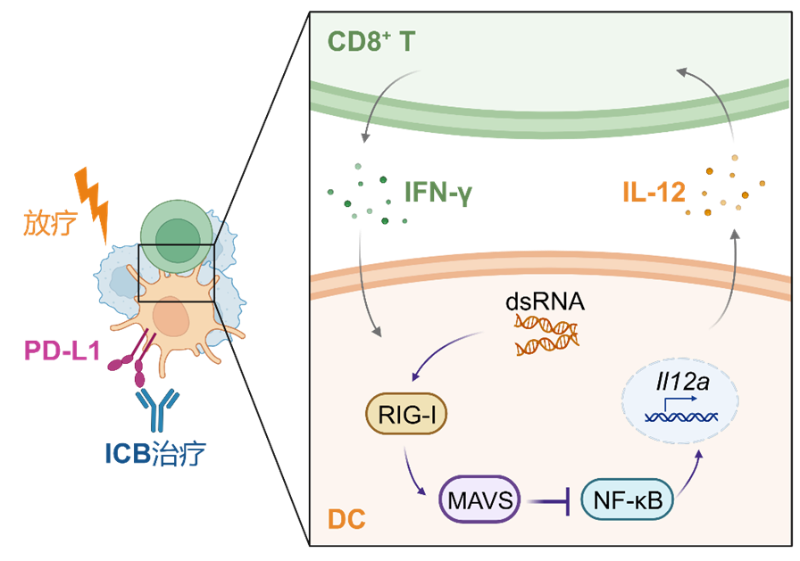 MAVS调控DC抗肿瘤免疫应答机制模式图
研究团队首先利用全身性基因敲除小鼠构建皮下移植肿瘤以及脑部原位胶质瘤模型发现机体MAVS加剧肿瘤生长。进一步借助骨髓嵌合体小鼠和条件性基因敲除小鼠,明确了DC是MAVS发挥抑制功能的主要载体,DC中特异性缺失MAVS能够增强CD8+ T细胞抗肿瘤免疫应答。此外,通过使用全身性敲除RIG-I或MDA5的小鼠构建皮下肿瘤,研究团队进一步剖析了RIG-I-MAVS轴对抗肿瘤应答的负向调控作用。机制方面,通过DC交叉激活功能分析、转录组水平分析及小分子抑制剂应用等手段,发现DC内RIG-I-MAVS轴通过非经典NF-κB通路抑制IL-12的产生,削弱了CD8+ T细胞的效应功能。
该研究发现机体RIG-I-MAVS通路伙同肿瘤细胞,编织牢笼禁锢DC,从而帮助肿瘤逃出生天。DC内的MAVS“包藏祸心”,“教唆”DC发挥抑制功能,束缚下游CD8+ T细胞行使效应功能。如果打破该牢笼,是否能重新恢复DC功能呢?基于上述发现,研究团队在免疫治疗、放射治疗以及放疗联合T细胞治疗多种治疗场景中阻断该信号,以期获得更好的治疗效果。结果发现机体缺失MAVS明显增强对免疫检查点抑制剂疗法及放射治疗的敏感性,还能增强放疗联合T细胞治疗对肿瘤的压制效果。这为临床治疗肿瘤策略的优化提供了新的方向。
综上所述,该项研究颠覆了以往对MAVS通路的认识,发现了MAVS通路是肿瘤浸润DC功能障碍的驱动因子,阐明了MAVS通路调控DC抗肿瘤免疫应答的新机制,建立了抑制而非激活MAVS通路增强肿瘤免疫治疗与放疗的合理策略,为理解肿瘤中T-DC细胞互作规律提供了新观点。
上海交通大学邓刘福教授为该论文的通讯作者,上海交通大学博士生吴龄龄和洪小川为共同第一作者。该研究受到了国家自然科学基金、上海交通大学“医工交叉研究基金”、上海市科委基础研究重点项目等项目资助,得到了上海交通大学医学院附属仁济医院的庄光磊教授的大力支持。
论文链接:https://www.science.org/doi/10.1126/sciimmunol.adf4919
MAVS调控DC抗肿瘤免疫应答机制模式图
研究团队首先利用全身性基因敲除小鼠构建皮下移植肿瘤以及脑部原位胶质瘤模型发现机体MAVS加剧肿瘤生长。进一步借助骨髓嵌合体小鼠和条件性基因敲除小鼠,明确了DC是MAVS发挥抑制功能的主要载体,DC中特异性缺失MAVS能够增强CD8+ T细胞抗肿瘤免疫应答。此外,通过使用全身性敲除RIG-I或MDA5的小鼠构建皮下肿瘤,研究团队进一步剖析了RIG-I-MAVS轴对抗肿瘤应答的负向调控作用。机制方面,通过DC交叉激活功能分析、转录组水平分析及小分子抑制剂应用等手段,发现DC内RIG-I-MAVS轴通过非经典NF-κB通路抑制IL-12的产生,削弱了CD8+ T细胞的效应功能。
该研究发现机体RIG-I-MAVS通路伙同肿瘤细胞,编织牢笼禁锢DC,从而帮助肿瘤逃出生天。DC内的MAVS“包藏祸心”,“教唆”DC发挥抑制功能,束缚下游CD8+ T细胞行使效应功能。如果打破该牢笼,是否能重新恢复DC功能呢?基于上述发现,研究团队在免疫治疗、放射治疗以及放疗联合T细胞治疗多种治疗场景中阻断该信号,以期获得更好的治疗效果。结果发现机体缺失MAVS明显增强对免疫检查点抑制剂疗法及放射治疗的敏感性,还能增强放疗联合T细胞治疗对肿瘤的压制效果。这为临床治疗肿瘤策略的优化提供了新的方向。
综上所述,该项研究颠覆了以往对MAVS通路的认识,发现了MAVS通路是肿瘤浸润DC功能障碍的驱动因子,阐明了MAVS通路调控DC抗肿瘤免疫应答的新机制,建立了抑制而非激活MAVS通路增强肿瘤免疫治疗与放疗的合理策略,为理解肿瘤中T-DC细胞互作规律提供了新观点。
上海交通大学邓刘福教授为该论文的通讯作者,上海交通大学博士生吴龄龄和洪小川为共同第一作者。该研究受到了国家自然科学基金、上海交通大学“医工交叉研究基金”、上海市科委基础研究重点项目等项目资助,得到了上海交通大学医学院附属仁济医院的庄光磊教授的大力支持。
论文链接:https://www.science.org/doi/10.1126/sciimmunol.adf4919 |