手性环丁烷不仅广泛存在于生物活性分子结构中,而且是有机化学中重要的合成子。最直接的和原子经济性的合成手性环丁烷的方法之一是金属催化环丁烯的不对称官能团化反应。虽然近些年来金属催化环丁烯的不对称官能团化反应,尤其是基于碳金属化过程的碳碳键形成反应得到很大发展,但仍然存在仅能引入芳基和酰基、反应模式单一等局限性。环丁烯由于其烯烃张力远小于环丙烯和桥环烯烃,通过环丁烯的不对称碳金属化过程的官能团化反应是极具挑战性的。目前该类反应仅局限于贵金属铑催化芳基硼酸或芳香醛的反应,而发展利用丰产金属钴催化,原位产生sp3杂化或sp杂化的亲核试剂与环丁烯通过碳金属化过程的不对称碳碳键形成的新反应模式,构建一系列多样化的手性环丁烷化合物、开发新基元反应是非常必要的。
中国科学院上海有机化学研究所金属有机化学国家重点实验室的孟繁柯课题组一直致力于钴催化的不对称反应的研究。在前期的研究中,孟繁柯课题组发展了一系列钴催化新型不对称反应(Angew. Chem. Int. Ed. 2019, 58, 11049 –11053;Angew. Chem. Int. Ed. 2021, 60, 2694–2698;Cell Reports Physical Science 2021, 2, 100406;J. Am. Chem. Soc. 2021, 143, 12755–12765; J. Am. Chem. Soc. 2022, 144, 5233–5240; Angew. Chem. Int. Ed. 2022, 61, e202205624)。近期,该课题组在探索环丁烯的不对称碳碳键形成反应过程中,利用手性膦配体,实现了高烯醇钴、炔基钴和烯丙基钴中间体与环丁烯的不对称碳金属化反应,多样化地构建了一系列手性环丁烷化合物,取得了新的研究进展。(J. Am. Chem. Soc. 2023, 145, 3588–3598)
孟繁柯课题组发现,通过环丙醇开环原位产生的高烯醇钴中间体,在膦噁唑啉配体促进下,与环丁烯发生高效高选择性地不对称烷基化反应;利用一价钴与炔烃的强配位活化端炔的碳氢键,产生的炔基钴中间体在富电子手性膦配体的诱导下,实现了与环丁烯的不对称氢炔基化反应;而通过烯丙基氟硼酸钾与富电子膦钴络合物发生转金属产生烯丙基钴中间体,与环丁烯发生不对称碳金属化反应串联1,3-钴迁移和β-碳碳键断裂反应,实现了一类手性1,3-二烯化合物的高选择性构建。通过机理研究,我们证实反应通过一种全新的基元反应1,3-钴迁移过程。产物经过进一步转化,合成一系列其它方法很难得到的多官能团化的手性环丁烷和1,3-二烯分子。
此项工作由有机所博士生梁志坤同学、王垒同学、硕士生王宇和王立凡完成。该研究得到科技部、国家自然科学基金委、上海市科委、中国科学院、上海有机所和金属有机化学国家重点实验室的大力资助。
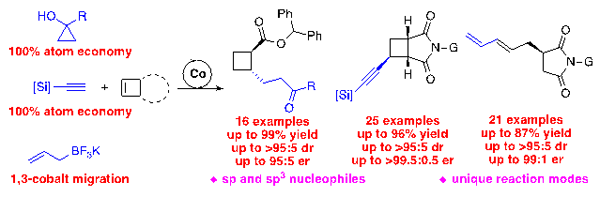 图:钴催化环丁烯的不对称碳碳键形成反应
图:钴催化环丁烯的不对称碳碳键形成反应 |