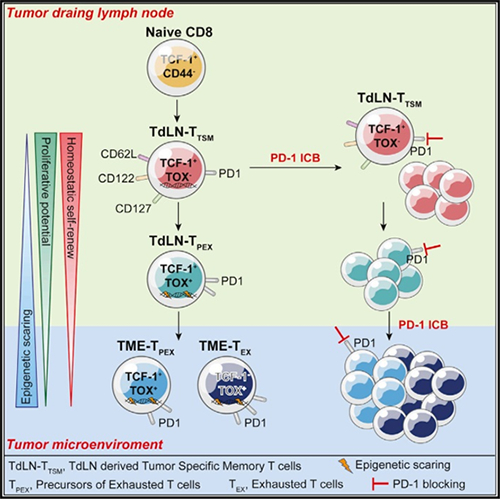
 图 肿瘤引流淋巴结中分化的TdLN-TTSM细胞进入肿瘤微环境中发挥作用
在国家自然科学基金项目(批准号:32030041、31825011)等资助下,陆军军医大学全军免疫学研究所叶丽林教授团队与中山大学唐忠辉团队及南京大学孙倍成团队合作在肿瘤免疫治疗领域取得新进展,首次发现在肿瘤引流淋巴结中存在肿瘤抗原特异性的记忆CD8+ T细胞,并证实了该群细胞在PD-1免疫检查点阻断疗法(Immune checkpoint blockade, ICB)治疗中的关键作用。研究成果以“原始分化的肿瘤特异性记忆CD8+T细胞是引流淋巴结中PD-1/PD-L1阻断的真正应答者(The primordial differentiation of tumor-specific memory CD8+ T cells as bona fide responders to PD-1/PD-L1 blockade in draining lymph nodes)”为题,于2022年10月7日在线发表于《细胞》(Cell)杂志。论文链接:https://www.cell.com/cell/fulltext/S0092-8674(22)01192-8。
CD8+ T细胞耗竭是机体免疫系统不能有效清除慢性病毒感染及恶性肿瘤的关键原因,通过单克隆抗体阻断PD-1介导的抑制性信号,可以在一定程度上逆转CD8+ T细胞耗竭,这也是目前PD-1临床应用的基础。靶向PD-1/PD-L1免疫检验点的单克隆抗体已被批准应用于临床治疗系列恶性肿瘤,但是该疗法对于胰腺癌、三阴性乳腺癌等恶性程度较高的肿瘤几乎无效,即便在有效的癌种中,只有少部分病人(20%-30%)可以相应,治疗后期也大多会出现耐药抵抗,只有极少数病人可以临床治愈。进一步提升PD-1 的响应人群及临床治愈潜力在很大程度上将依赖于对PD-1 作用机制的深入研究。叶丽林教授课题组及国际其他研究团队在2016年曾分别报道了淋巴组织内耗竭程度较低的CD8+ T细胞(Tpex)作为耗竭前体细胞,功能性响应PD-1 ICB。该发现打破了耗竭T细胞作为“僵尸”细胞的传统观点,引领了T细胞耗竭领域的研究热点,但是恶性肿瘤微环境中的T细胞响应PD-1 ICB的时空调控机制仍未厘清。
叶丽林教授团队利用多种移植瘤及原位肿瘤诱导模型,检测了引流淋巴结(TdLNs)内的肿瘤特异性CD8+ T细胞,发现一定比例细胞高表达TCF-1,低表达PD-1,但不表达耗竭特异性的转录因子TOX,该细胞亚群(TOX-PD-1loTCF-1+)严格符合经典免疫记忆特征。通过高通量测序分析,他们发现在单细胞层面这群CD8+ T细胞的转录特征也更接近经典记忆细胞,而与耗竭T细胞的差异较大。基于典型的记忆性特征和特殊组织定位,他们将其命名为肿瘤引流淋巴结抗原特异性记忆CD8+ T细胞,即TdLN-TTSM(Tumor Draining Lymph Node derived Tumor Specific memory T cell)。进一步的体内和体外实验中发现,在PD-1/PD-L1 ICB治疗前或治疗中,去除TdLN-TTSM细胞亚群均导致PD-L1阻断抗体介导的免疫治疗失效,而回输此类细胞则可以恢复此作用,进一步验证了TdLN-TTSM是真正响应了PD1 ICB的细胞亚群。
该研究发现了肿瘤引流淋巴结中的全新抗原特异性记忆性T细胞;打破了“在肿瘤负荷下只存在耗竭T细胞,不存在肿瘤特异性记忆T细胞”这一传统观念;完善了肿瘤组织微环境中PD-1 ICB作用的时空调控机制,为进一步优化肿瘤免疫治疗提供了重要理论基础。
图 肿瘤引流淋巴结中分化的TdLN-TTSM细胞进入肿瘤微环境中发挥作用
在国家自然科学基金项目(批准号:32030041、31825011)等资助下,陆军军医大学全军免疫学研究所叶丽林教授团队与中山大学唐忠辉团队及南京大学孙倍成团队合作在肿瘤免疫治疗领域取得新进展,首次发现在肿瘤引流淋巴结中存在肿瘤抗原特异性的记忆CD8+ T细胞,并证实了该群细胞在PD-1免疫检查点阻断疗法(Immune checkpoint blockade, ICB)治疗中的关键作用。研究成果以“原始分化的肿瘤特异性记忆CD8+T细胞是引流淋巴结中PD-1/PD-L1阻断的真正应答者(The primordial differentiation of tumor-specific memory CD8+ T cells as bona fide responders to PD-1/PD-L1 blockade in draining lymph nodes)”为题,于2022年10月7日在线发表于《细胞》(Cell)杂志。论文链接:https://www.cell.com/cell/fulltext/S0092-8674(22)01192-8。
CD8+ T细胞耗竭是机体免疫系统不能有效清除慢性病毒感染及恶性肿瘤的关键原因,通过单克隆抗体阻断PD-1介导的抑制性信号,可以在一定程度上逆转CD8+ T细胞耗竭,这也是目前PD-1临床应用的基础。靶向PD-1/PD-L1免疫检验点的单克隆抗体已被批准应用于临床治疗系列恶性肿瘤,但是该疗法对于胰腺癌、三阴性乳腺癌等恶性程度较高的肿瘤几乎无效,即便在有效的癌种中,只有少部分病人(20%-30%)可以相应,治疗后期也大多会出现耐药抵抗,只有极少数病人可以临床治愈。进一步提升PD-1 的响应人群及临床治愈潜力在很大程度上将依赖于对PD-1 作用机制的深入研究。叶丽林教授课题组及国际其他研究团队在2016年曾分别报道了淋巴组织内耗竭程度较低的CD8+ T细胞(Tpex)作为耗竭前体细胞,功能性响应PD-1 ICB。该发现打破了耗竭T细胞作为“僵尸”细胞的传统观点,引领了T细胞耗竭领域的研究热点,但是恶性肿瘤微环境中的T细胞响应PD-1 ICB的时空调控机制仍未厘清。
叶丽林教授团队利用多种移植瘤及原位肿瘤诱导模型,检测了引流淋巴结(TdLNs)内的肿瘤特异性CD8+ T细胞,发现一定比例细胞高表达TCF-1,低表达PD-1,但不表达耗竭特异性的转录因子TOX,该细胞亚群(TOX-PD-1loTCF-1+)严格符合经典免疫记忆特征。通过高通量测序分析,他们发现在单细胞层面这群CD8+ T细胞的转录特征也更接近经典记忆细胞,而与耗竭T细胞的差异较大。基于典型的记忆性特征和特殊组织定位,他们将其命名为肿瘤引流淋巴结抗原特异性记忆CD8+ T细胞,即TdLN-TTSM(Tumor Draining Lymph Node derived Tumor Specific memory T cell)。进一步的体内和体外实验中发现,在PD-1/PD-L1 ICB治疗前或治疗中,去除TdLN-TTSM细胞亚群均导致PD-L1阻断抗体介导的免疫治疗失效,而回输此类细胞则可以恢复此作用,进一步验证了TdLN-TTSM是真正响应了PD1 ICB的细胞亚群。
该研究发现了肿瘤引流淋巴结中的全新抗原特异性记忆性T细胞;打破了“在肿瘤负荷下只存在耗竭T细胞,不存在肿瘤特异性记忆T细胞”这一传统观念;完善了肿瘤组织微环境中PD-1 ICB作用的时空调控机制,为进一步优化肿瘤免疫治疗提供了重要理论基础。
|